Os gases ideais, por sua vez, são modelos idealizados para facilitar os estudos. Isso porque eles apresentam sempre uma de suas grandezas de forma constante. Ou seja, a temperatura ou o volume são constantes. As demais são variáveis.
As relações da temperatura, pressão e volume de um sistema gasoso dão origem à Lei dos Gases. Tais relações envolvendo os sistemas gasosos foram criadas por físico-químicos entre os séculos XVII e XIX. Aliás, tais cientistas dão nomes a elas, sendo:
- Lei de Boyle (transformação isotérmica)
- Lei de Gay-Lussac (transformação isobárica)
- Lei de Charles (transformação isométrica)
A Lei de Boyle-Mariotte: isotermia
Equação da lei de Boyle:

Sendo:
p: pressão da amostra
V: volume
K: constante de temperatura (depende da natureza do gás, da temperatura e da massa)
Essa lei a respeito dos sistemas gasosos apresenta a transformação isotérmica dos gases ideais. A temperatura permanece constante e, consequentemente, a pressão e o volume são inversamente proporcionais.
Por exemplo:
Então, se utilizarmos uma seringa sem agulha cheia de um gás determinado em estado ideal, e fecharmos sua extremidade inferior, pressionando a seringa, teremos uma variação de volume e uma determinada pressão.
Assim, se a temperatura se mantiver constante, veremos que o volume será inversamente proporcional à pressão.
A Lei de Gay-Lussac: isobaria
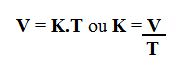
Sendo que:
V: volume do gás
T: temperatura
k: constante da pressão (isobárica)
Apresenta a transformação isobárica dos gases, sendo assim, quando a pressão do gás é constante, em consequência a temperatura e o volume são diretamente proporcionais.
Por exemplo:
Quando um gás é colocado em um recipiente a um volume constante, é possível verificar que se uma pressão for exercida sobre esse ele, consequentemente ocorrerá um aumento proporcional da temperatura absoluta do mesmo.
A Lei de Charles: isometria
A equação da lei de Charles:
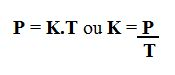
Sendo:
P: pressão
T: temperatura
K: constante de volume (depende da natureza, do volume e da massa do gás)
Apresenta a transformação isométrica dos gases ideias. Onde o volume do gás é constante. Já a pressão e a temperatura são grandezas diretamente proporcionais.
Por exemplo:
Podemos utilizar um recipiente completo por um gás ideal com determinada pressão e determinada temperatura. Podemos mudar essas duas variáveis mantendo o volume constante.
Desse modo, iremos perceber que a pressão sempre será diretamente proporcional à temperatura. Isso porque mantivemos o volume constante.
Exercícios resolvidos
Vamos praticar seus conhecimentos?
- Em um recipiente fechado, certa massa de gás ideal ocupa um volume de 12 litros a 293k. Se este gás for aquecido até 302k, sob pressão constante, seu volume será:
- 12,37 L
- 13,37 L
- 14,37 L
- 12 L
- 13 L
Resolução:
Primeiro de tudo, analisando o enunciado, veremos que ele apresenta a informação de que o gás foi aquecido sob pressão constante.
Desta forma, podemos deduzir que se trata de uma transformação isobárica. Sendo assim, aplicamos a equação de Gay – Lussac. Sendo:
V1 = 12 L
T1 = 293 k
T1 = 302 k
V2 = ?

Dicas Enem
Então, quer sair na frente e se dar bem no Enem? Não deixe de fazer um programa de estudos envolvendo a Lei dos Gases.
Desejamos ótimos estudos e um excelente exame!


